
SIBO (small intestine bacterial overgrowth), dobro je prepoznat uzrok maldigestije i malapsorpcije širom sveta. Od nedavno je stekao pažnju kao održivo objašnjenje za širok spektar gastrointestinalnih smetnji.
Istorijski gledano, SIBO se dugo smatrao kontroverznom i spornom dijagnozom.
Veliki deo kontroverze oko SIBO dijagnoze potiče iz širokog opsega kliničkih prikaza i značajnog preklapanja sa drugim heterogenim dijagnozama, a sindrom iritabilnog creva (IBS) je najcitiraniji primer.
Dvosmislenost oko SIBO-a je nedostatak konsenzusa kada je u pitanju dijagnostikovanje i lečenje stanja.
Međutim, nedavno se mnogo toga promenilo u našem razumevanju SIBO-a i kako pristupiti lečenju.
Ranije korišćeni jejunalni aspirati i analize tečnosti duodenuma zamenjeni su izdisajnim testovima, dok novo objavljene smernice pružaju jasniju sliku o tumačenju dijagnostičkih podataka, izdisajnog testa.
Bolje razumevanje mikrobioma tankog creva pokazalo se ključnim u razotkrivanju SIBO, jer pomaže kliničarima da utvrde validnost bilo koje dijagnostičke metode koja se koristi za otkrivanje ovog stanja.
Razumevanje humanog mikrobioma tankog creva naglo je napredovalo tokom poslednjih godina.
Istorijski gledano, većina studija mikrobioma creva zasnivala se na ispitivanju fecesa koje pružaju dragocene informacije o mikrobiomu debelog creva, ali nisu uspele da odgovore na ključna pitanja u vezi sa bakterijama koje naseljavaju tanko crevo.
U ljudskom crevu živi 1014 bakterijskih ćelija, što je otprilike 10 puta više od broja ćelija u ljudskom telu (1) Ovaj raznoliki mikrobiom sastoji se od širokog spektra organizama, uključujući bakterije, gljivice i viruse.
Bakterije okupiraju najveći deo ovog mikrobioma, sa približno 500 do 1.000 različitih bakterijskih vrsta do danas identifikovanih (2).
Broj bakterija se povećava kretajući se iz proksimalnog tankog creva u debelo crevo.
Tanko crevo se sastoji uglavnom od gram pozitivnih i aerobnih bakterija, dok debelo crevo sadrži pretežno gram negativne i anaerobne bakterije.
Glavni bakterijski filum u crevima uključuje Bacteroidetes i Firmicutes, dok su Actinobacteria, Fusobacteria, Verrucomicrobia i Cianobacteria takođe prisutne, mada u manjoj proporciji (3).
Prevalenca (ukupan broj obolelih osoba unutar neke populacije u datom vremenskom trenutku) SIBO-om, među opštom populacijom nije poznata. Međutim, u većini studija, SIBO je otkriven od 0 do 20% zdravih kontrola (4,5).
Najčešći faktori rizika za SIBO uključuju poremećaji u anatomiji i pokretljivosti tankog creva.
Često citirani primeri rizika uključuju:
Pored toga, oštećenja u normalnom biohemijskom čišćenju bakterija takođe predisponiraju prekomerni rast bakterija. To uključuje:
Smanjena pokretljivost creva je dugo dokumentovana kao potencijalni faktor rizika za SIBO.
Nedavna studija (n = 150) dizajnirana da istraži ulogu dismotilnosti i upotrebe PPI kod pacijenata sa upornim gastrointestinalnim tegobama pokazala je da pacijenti sa slabijom pokretljivosti tankog creva imaju povećani rizik za SIBO na osnovu duodenalnog aspirata (6).
Ostali gastrointestinalni poremećaji su takođe povezani sa razvojem SIBO. Najvažnije je da su zapaljenska bolest creva (IBD), dispepsija, pankreatitis i istorija prethodne *kolektomije navedeni kao potencijalni faktori rizika za povećanim rastom bakterija.
*Kolektomija je operativni zahvat kojim se uklanja deo debelog creva (parcijalna kolektomija) ili celo debelo crevo (totalna kolektomija).
U studiji kontrole slučaja iz 2018. godine, pacijentima koji su bili podvrgnuti kolektomiji dijagnostikovan je SIBO u znatno većem procentu u poređenju sa onima sa dugotrajnim gastrointestinalnim simptomima bez prethodne kolektomije (62% u odnosu na 32%, respektivno, P = 0,0005) (7).
Meta analiza 2019. godine sprovedena sa ciljem da se pregleda prevalenca SIBO među pacijentima sa ulceroznim kolitisom i Crohnovom bolešću pokazala je direktnu korelaciju između IBD i SIBO (8).
Veza između upotrebe PPI i SIBO pokazala se kontroverznom u prošlosti jer početne studije nisu pokazale direktnu korelaciju između njihove upotrebe i povećane osetljivosti na prekomerni rast bakterija. Međutim, naknadne studije su potvrdile vezu. (9).
Strukturne abnormalnosti koje uključuju ileocekalni ventil takođe su navedene kao potencijalni faktor rizika za SIBO.
Predloženi mehanizam uključuje abnormalni ili neodgovarajući refluks mikrobiote debelog creva u ilealni deo tankog creva (10).
Trenutni zlatni standard za dijagnozu ostaje kvantitativna kultura usisane tečnosti tankog creva. Međutim, visoki troškovi postupka, u kombinaciji sa invazivnom prirodom procedure, učinili su ga manje idealnim za mnoge pacijente.
Ograničenja postupka, uključujući različite koncentracije bakterija, zajedno sa tankim crevima i mogućom kontaminacijom orofaringealnom florom, čine ga nepraktičnim za rutinsku kliničku upotrebu.
Takođe, važno je napomenuti da visok procenat bakterija koje kolonizuju creva ne može da se uzgaja i da neravnomerna distribucija bakterija zajedno sa tankim crevima sprečava tačnu kvantifikaciju prekomernog rasta bakterija (11-13).
Testovi daha su jednostavne, neinvazivne, za pacijenta prilagođene metode za dijagnozu prekomernog rasta bakterija.Praktična priroda postupka učinili su ga dijagnostičkim alatom u kliničkoj praksi.
Dijagnostička uloga testova udisanja vodonika u velikoj meri zavisi od vrste supstrata koji se koristi.
Na primer, testovi daha laktoze na vodonik korisni su u slučajevima malabsorpcije ugljenih hidrata, dok su testovi daha laktuloze i glukoze na vodonik korisni za dijagnozu prekomernog rasta bakterija.
Kod pacijenata sa malapsorpcijom ugljenih hidrata, crevna flora creva proizvodi vodonik i metan iz unesenih supstrata; kod pacijenata sa SIBO, bakterije tankog creva proizvode iste te gasove. Većina proizvedenih gasova brzo se eliminiše prolazećim flatusom.
Međutim, oko 20% gasova apsorbuju pluća, a zatim ih izdahnu, što omogućava kvantitativno merenje tokom izdisajnog testiranja.
Suprotno prethodnim studijama, gde merenje nivoa metana nije povećalo prinos ispitivanja daha vodonika, nedavni podaci sugerišu da provera nivoa metana povećava dijagnostički prinos ispitivanja daha vodonika i trebalo bi ga koristiti u dijagnostičke svrhe (3,14).
Smernice preporučuju zaustavljanje upotrebe antibiotika pre testiranja, jer je njihova upotreba povezana sa izmenjenim sastavom vodonika i metana izdahnutog daha (3, 15).
Uprkos nedostatku jasnih podataka, generalno se preporučuje 2-4 nedelje između prestanka uzimanja antibiotika i dijagnostičkog ispitivanja (3, 16).
Nizak nivo vodonika na dah je presudan za pravilno tumačenje rezultata testova daha, jer na nivo vodonika direktno utiče potrošnja fermentabilnih složenih ugljenih hidrata (16.17).
Zbog toga se sada preporučuje da pacijenti izbegavaju složene ugljene hidrate i mlečne proizvode uveče pre ili 24 sata pre testiranja.
Pored toga, pušenje povećava koncentraciju vodonika u izdisaju i treba ga izbegavati na dan testiranja, kao što je predloženo u nedavno objavljenom severnoameričkom konsenzusu o ispitivanju daha na vodonik i metan (3).
Laboratorijski podaci se mogu koristiti za potvrđivanje sumnje na SIBO u slučajevima kada dijagnostički modaliteti nisu bili konačni.
Simptomi SIBO mogu biti raznoliki:
SIBO je klasično povezan sa nutritivnim nedostacima, sa nivoima vitamina B12 na koje se često utiče zbog inhibirane apsorpcije i / ili kompetitivnog unosa bakterija.
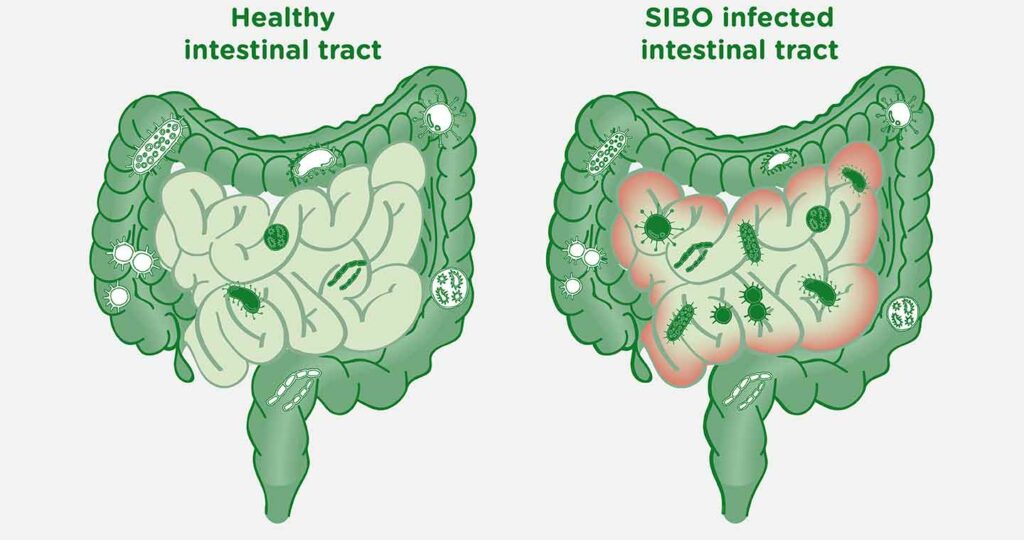
Iako postoje određene bakterije koje proizvode B12, većina crevnih bakterija su potrošači, što uzrokuje nutritivni nedostatak.
Nivo folata se često povećava kod SIBO, jer je vitamin nusprodukt bakterijskog metabolizma (18).
Takođe su zabeleženi nedostaci vitamina rastvorljivih u masti (A, D, E, K) kao rezultat malapsorpcije masti, povremeno imajući klinički značajne implikacije, u rasponu od smanjene gustine kostiju, osteoporoze i neuropatije (19).
Sistemski antibiotici
Obzirom na ograničenja trenutnih dijagnostičkih tehnika, kliničari često započinju empirijsku terapiju kao dijagnostički alat kod onih sa visokim nivoom sumnje na SIBO. Međutim, ova strategija sama po sebi može biti problematična jer izlaže pacijente rizicima od antibiotske terapije, uključujući razvoj organizama i infekcija otpornih na antibiotike (tj. Kolitis Clostridium difficile).
Tradicionalno, antibiotici za lečenje SIBO sastojali su se od tetraciklina, fluorokinolona i kotrimoksazola. Međutim, rifaksimin se pojavio kao omiljeno sredstvo među kliničarima za upravljanje SIBO-om.
Rifaksimin je neapsorbujući antibiotik koji deluje protiv gram-pozitivnih i gram-negativnih aerobnih i anaerobnih bakterija. Poželjna upotreba rifaksimina potiče iz smanjenog profila toksičnosti i njegove korisnosti u sindromu iritabilnog creva, dijagnozi sa značajnim kliničkim preklapanjem sa SIBO.
Dalje, podaci pokazuju da rifaksimin može delovati kao „eubotični“ agens očuvanjem flore debelog creva, istovremeno povećavajući relativnu zastupljenost laktobacila i bifidobakterija u crevima (20).
Izgleda da je i stopa iskorenjivanja SIBO-a povezana sa dozom. Ranije sprovedena studija prijavila je dozu zavisnu stopu eradikacije gde su veće doze rifaksimina povezane sa većom stopom eradikacije (21).
U nedavnoj meta analizi koja je imala za cilj ispitivanje efikasnosti rifaksimina u prekomernom razmnožavanju bakterija, efikasnost rifaksimina u iskorenjivanju SIBO iznosila je 64% u poređenju sa 41% kod drugih sistemskih antibiotika, uključujući tetracikline i metronidazol (22).
Druga meta analiza koja je proučavala osam studija pokazala je da je efikasnost rifaksimina u normalizaciji brzine daha bila 49,5% (23).
Razne alternativne terapije predložene su tokom poslednjih godina, od kojih mnoge potiču izvan medicinske zajednice. Uprkos nedostatku dodatnih podataka, alternativna terapija može predstavljati realnu mogućnost za one koji ne reaguju na tradicionalne metode lečenja.
Probiotici
Probiotici su živi mikroorganizmi, koji mogu ublažiti simptome SIBO kada se daju u dovoljnim količinama. Probiotici deluju kroz više mehanizama, uključujući modulaciju crevne mikrobiote, održavajući integritet crevnog epitela, regulišući antiinflamatorne citokine i faktore rasta, proizvodnju masnih kiselina kratkog i razgranatog lanca, kao i interakciju sa osom mozga i creva, regulisanjem endokrinih i neuroloških funkcija (24).
Nedavna meta analiza je sugerisala da probiotici efikasno smanjuju bakterijski teret kod SIBO pacijenata i ublažavaju njihove simptome (25).
Dalje, probiotici mogu poboljšati efikasnost antibiotika, što je pokazano u nedavnoj studiji u kojoj su pacijenti lečeni rifaksiminom zajedno sa probioticima (Lactobacillus casei) imali veće poboljšanje simptoma dvostrukom terapijom za razliku od samih antibiotika (26).
Suprotno tome, nedavna studija takođe je pokazala da probiotici mogu izazvati simptome kod SIBO pacijenata, uključujući gasove, nadimanje i maglovitost mozga (27).
To sugeriše da nisu svi probiotici jednake efikasnosti i da ih treba koristiti sa oprezom kod pacijenata sa SIBO.
Biljni dodaci
Biljni suplementi koji se prodaju za ublažavanje SIBO su široko dostupni i postaju sve popularniji jer se mnogi okreću tradicionalnoj farmakološkoj terapiji u potrazi za alternativnim i jeftinijim metodama.
Nedavna studija pokazala je da biljni dodaci mogu biti jednako efikasni kao rifaksimin.
Studija (n = 251) je proučavala pacijente koji su imali pozitivan test na SIBO nakon testiranja daha laktuloze (LBT).
U studiji su ispitanici sa novodijagnostikovanim SIBO dobili dva izbora lečenja;
Nakon čega je usledio ponovljeni LBT.
Ista studija je zaključila da biljna terapija ima sličnu efikasnost kao trostruka antibiotska terapija za SIBO spasilačka terapija za rifaksimin koji nije reagovao (28).
Međutim, važno je napomenuti da su podaci o biljnim suplementima za SIBO izuzetno ograničeni i proizvodi koji su trenutno dostupni značajno se razlikuju u sastavu i kvalitetu.
Dijetalna ishrana može biti korisna za ublažavanje simptoma SIBO-a, uključujući nadimanje i bolove u stomaku.
Kod pacijenata sa SIBO, crevne bakterije fermentišu ugljene hidrate, kao što su fruktoza, laktoza, oligosaharidi, disaharidi i monosaharidi, što rezultira stvaranjem gasova i gore pomenutim simptomima.
Dijeta sa malim udelom FODMAP (fermentabilni oligosaharidi, disaharidi, monosaharidi i polioli) verovatno je najpoznatija dijeta za SIBO; međutim, većina podataka o njegovoj efikasnosti zasniva se na IBS, koji se značajno preklapa sa SIBO.
FODMAP predstavlja listu šećera koji se mogu fermentirati u crevima. Odabrane bakterije nastanjene u tankom crevu uspevaju konzumiranjem FODMAPS-a, stoga ograničavanje njihovog broja uskraćuje bakterijama prijeko potrebnu ishranu potrebnu za rast i razmnožavanje.
Iako efikasne, FODMAP dijete mogu biti složene i teško se pridržavati ih bez stručnog vođenja. Većina pacijenata koristi profesionalnu savete u različitim fazama dijete, identifikaciju okidača, sporo izbacivanje hrane i njihovo ponovno uvođenje u svakodnevnu ishranu.
Dalje, podaci pokazuju da ishrana bogata složenim ugljenim hidratima može favorizovati razmnožavanje manje patogenih bakterija u poređenju sa dijetama bogatom mastima ili proteinima (29).
Veganska i vegetarijanska ishrana bogata vlaknima pokazala se efikasnom za mnoge koji imaju SIBO simptome. Ove dijete povećavaju proizvodnju masnih kiselina sa kratkim lancima, dok istovremeno inhibiraju potencijalno invazivne bakterije, kao što su Escherichia coli i drugi pripadnici vrsta Enterobacteriaceae [30].
Osnovna dijeta je tečna ishrana koja se obično koristi za pacijente koji imaju ugrožen ili oštećen digestivni sistem. Ova vrsta ishrane je predložena kao opcija za potencijalno ublažavanje simptoma SIBO.
Uprkos dokazanoj efikasnosti antibiotika za ublažavanje simptoma, približno 40% pacijenata sa simptomima sličnim SIBO-u možda neće ostvariti rešavanje svojih simptoma antibiotskom terapijom.
Oni koji ne uspeju na standardnoj terapiji treba da se podvrgnu proceni drugih preklapajućih dijagnoza.
Pacijenti sa dvostrukim stanjima, kao što su SIBO i intolerancija na laktozu, možda će delimično ublažiti simptome samo antibiotskom terapijom i dugoročno će im trebati dijete bez laktoze. Kao takva, potrebna je temeljna procena simptoma i odgovarajuće dijagnostičko ispitivanje da bi se isključila druga stanja kod onih sa suboptimalnim odgovorom na antibiotsku terapiju.
SIBO ostaje široko rasprostranjena dijagnoza u tercijarnoj referalnoj gastroenterološkoj praksi. Iako je postignut značajan napredak u našem razumevanju stanja, napori da se potpuno razotkrije ova složena dijagnoza i dalje su ometeni ograničenjima trenutno dostupnih dijagnostičkih alata.
Iako nedostaje savršen dijagnostički test za SIBO, trenutno dostupno testiranje daha (izdisajni test) pokazalo se sigurnom i poželjnom metodom u kliničkoj praksi.
Iako je SIBO i dalje kontroverzna dijagnoza, u eri bujnog istraživanja mikrobioma, gastroenterolozi i drugi kliničari sigurno će postati sve više svesni SIBO-a u opštoj populaciji, omogućavajući im da obezbede efikasniji tretman.
U Beo-lab laboratoriji dostupan vam je neinvazivan izdisajni SIBO test koji meri gasove vodonika (H2) i metana (CH4) nakon što pacijent popije rastvor laktuloze radi procene bakterijskog prekomernog rasta u tankom crevu.
U pitanju je jedna od analiza specijalne laboratorijske dijagnostike kabineta za funkcionalnu medicinu koji vodi dr Milka Popović.
Analiza se vrši na uzorku izdahnutog vazduha. Uzorak je potrebno dostaviti u posebnim epruvetama (dobićete specijalni komplet za uzorkovanje, kao i uputstvo za uzorkovanje u kućnim uslovima).
Za više informacije i konsultacije oko SIBO testa pišite nam na mail funkcionalnamedicina@beo-lab.rs
SAZNAJ VIŠE
Reference:
1. Gerritsen J, Smidt H, Rijkers GT, De vos WM: Intestinal microbiota in human health and
disease: the impact of probiotics. Genes Nutr. 2011, 6:209-240. 10.1007/s12263-011-0229-7
2. Lagier JC, Million M, Hugon P, Armougom F, Raoult D: Human gut microbiota: repertoire and
variations. Front Cell Infect Microbiol. 2012, 2:136. 10.3389/fcimb.2012.00136
3. Rezaie A, Buresi M, Lembo A, et al.: Hydrogen and methane-based breath testing in
gastrointestinal disorders: the North American Consensus. Am J Gastroenterol. 2017, 112:775-
784. 10.1038/ajg.2017.46
4. Suda W, Ogata Y, Nishijima S: Analysis of human microbiome using NGS (Article in Japanese) .
Clin Calcium. 2018, 28:1274-1281.
5. Grace E, Shaw C, Whelan K, Andreyev HJ: Review article: small intestinal bacterial
overgrowth–prevalence, clinical features, current and developing diagnostic tests, and
treatment. Aliment Pharmacol Ther. 2013, 38:674-688. 10.1111/apt.12456
6. Jacobs C, Coss Adame E, Attaluri A, Valestin J, Rao SS: Dysmotility and proton pump inhibitor
use are independent risk factors for small intestinal bacterial and/or fungal overgrowth.
Aliment Pharmacol Ther. 2013, 37:1103-1111. 10.1111/apt.12304
7. Rao SSC, Tan G, Abdulla H, Yu S, Larion S, Leelasinjaroen P: Does colectomy predispose to
small intestinal bacterial (SIBO) and fungal overgrowth (SIFO)?. Clin Transl Gastroenterol.
2018, 9:146. 10.1038/s41424-018-0011-x
8. Shah A, Morrison M, Burger D, et al.: Systematic review with meta-analysis: the prevalence of
small intestinal bacterial overgrowth in inflammatory bowel disease. Aliment Pharmacol
Ther. 2019, 49:624-635. 10.1111/apt.15133
9. Su T, Lai S, Lee A, He X, Chen S: Meta-analysis: proton pump inhibitors moderately increase
the risk of small intestinal bacterial overgrowth. J Gastroenterol. 2018, 53:27-36.
10.1007/s00535-017-1371-9
10. Chander Roland B, Mullin GE, Passi M, Zheng X, Salem A, Yolken R, Pasricha PJ: A
prospective evaluation of ileocecal valve dysfunction and intestinal motility derangements in
small intestinal bacterial overgrowth. Dig Dis Sci. 2017, 62:3525-3535. 10.1007/s10620-017-
4726-4
11. Ghoshal UC, Shukla R, Ghoshal U, Gwee KA, Ng SC, Quigley EM: The gut microbiota and
irritable bowel syndrome: friend or foe?. Int J Inflam. 2012, 2012:151085.
10.1155/2012/151085
12. Ziegler TR, Cole CR: Small bowel bacterial overgrowth in adults: a potential contributor to
intestinal failure. Curr Gastroenterol Rep. 2007, 9:463-467. 10.1007/s11894-007-0060-x
13. Ghoshal UC, Srivastava D, Ghoshal U, Misra A: Breath tests in the diagnosis of small
intestinal bacterial overgrowth in patients with irritable bowel syndrome in comparison with
quantitative upper gut aspirate culture. Eur J Gastroenterol Hepatol. 2014, 26:753-760.
10.1097/MEG.0000000000000122
14. Pimentel M, Chang C, Chua KS, Mirocha J, DiBaise J, Rao S, Amichai M: Antibiotic treatmentof constipation-predominant irritable bowel syndrome. Dig Dis Sci. 2014, 59:1278-1285.
10.1007/s10620-014-3157-8
15. Gasbarrini A, Corazza GR, Gasbarrini G, et al.: Methodology and indications of H2-breath
testing in gastrointestinal diseases: the Rome Consensus Conference. Aliment Pharmacol
Ther. 2009, 29:1-49. 10.1111/j.1365-2036.2009.03951.x
16. Levitt MD, Hirsh P, Fetzer CA, Sheahan M, Levine AS: H2 excretion after ingestion of complex
carbohydrates. Gastroenterology. 1987, 92:383-389.
17. Dukowicz AC, Lacy BE, Levine GM: Small intestinal bacterial overgrowth: a comprehensive
review. Gastroenterol Hepatol (NY). 2007, 3:112-122.
18. Oliveira RB, Martinelli ALC, Troncon LEA, Elias J Jr: Small intestinal bacterial overgrowth
(SIBO) and vitamin K-responsive coagulopathy: a previously unrecorded association. BMJ Case
Rep. 2018, 2018:bcr2017223531. 10.1136/bcr-2017-223531
19. Sarangi AN, Goel A, Aggarwal R: Methods for studying gut microbiota: a primer for physicians .
J Clin Exp Hepatol. 2019, 9:62-73. 10.1016/j.jceh.2018.04.016
20. Maccaferri S, Vitali B, Klinder A, et al.: Rifaximin modulates the colonic microbiota of
patients with Crohn’s disease: an in vitro approach using a continuous culture colonic model
system. J Antimicrob Chemother. 2010, 65:2556-2565. 10.1093/jac/dkq345
21. Scarpellini E, Gabrielli M, Lauritano CE, et al.: High dosage rifaximin for the treatment of
small intestinal bacterial overgrowth. Aliment Pharmacol Ther. 2007, 25:781-786.
10.1111/j.1365-2036.2007.03259.x
22. Gatta L, Scarpignato C: Systematic review with meta-analysis: rifaximin is effective and safe
for the treatment of small intestine bacterial overgrowth. Aliment Pharmacol Ther. 2017,
45:604-616. 10.1111/apt.13928
23. Shah SC, Day LW, Somsouk M, Sewell JL: Meta-analysis: antibiotic therapy for small intestinal
bacterial overgrowth. Aliment Pharmacol Ther. 2013, 38:925-934. 10.1111/apt.12479
24. Plaza-Diaz J, Ruiz-Ojeda FJ, Gil-Campos M, Gil A: Mechanisms of action of probiotics . Adv
Nutr. 2019, 10:S49-66. 10.1093/advances/nmy063
25. Zhong C, Qu C, Wang B, Liang S, Zeng B: Probiotics for preventing and treating small
intestinal bacterial overgrowth: a meta-analysis and systematic review of current evidence. J
Clin Gastroenterol. 2017, 51:300-311. 10.1097/MCG.0000000000000814
26. Rosania R, Giorgio F, Principi M, Amoruso A, Monno R, Di Leo A, Ierardi E: Effect of probiotic
or prebiotic supplementation on antibiotic therapy in the small intestinal bacterial
overgrowth: a comparative evaluation. Curr Clin Pharmacol. 2013, 8:169-172.
10.2174/15748847113089990048
27. Rao SSC, Rehman A, Yu S, Andino NM: Brain fogginess, gas and bloating: a link between
SIBO, probiotics and metabolic acidosis. Clin Transl Gastroenterol. 2018, 9:162.
10.1038/s41424-018-0030-7
28. Chedid V, Dhalla S, Clarke JO, et al.: Herbal therapy is equivalent to rifaximin for the
treatment of small intestinal bacterial overgrowth. Glob Adv Health Med. 2014, 3:16-24.
10.7453/gahmj.2014.019c
29. Brown K, Decoffe D, Molcan E, Gibson DL: Diet-induced dysbiosis of the intestinal microbiota
and the effects on immunity and disease. Nutrients. 2012, 4:1095-1119. 10.3390/nu4081095
30. Zimmer J, Lange B, Frick JS, et al.: A vegan or vegetarian diet substantially alters the human
colonic faecal microbiota. Eur J Clin Nutr. 2012, 66:53-60. 10.1038/ejcn.2011.141
Ukoliko Vam se sviđa članak podelite ga sa prijateljima.
Najnovije objave
Preventivni paneli
Beo-lab tim odgovara na vaša pitanja
Samo u Beo-lab laboratorijama laboratorijske analize možete poručiti onlajn.


Ako se vratimo u istoriju i pogledamo unazad, sve značajne kompanije u svetu su krenule sitnim koracima, kombinujući viziju, upornost, strpljenje, šanse i inovacije.
Istorija razvoja Beo-lab laboratorija u tom smislu, nije izuzetak.
Vraćamo se unazad samo da bi videli koliko nas je fokus na srce Beo-Laba odveo napred.
Srce naše kompanije su pacijenti i njihove potrebe iz oblasti laboratorijske dijagnostike.

Mreža laboratorija
Posećeni linkovi
Nove analize
Beo-lab laboratorije, Medicover/Synevo , pripadajući logotip i sve povezane Beo-lab marke su registrovani zaštitni znakovi kompanije Beo-lab laboratorije. Sve oznake trećih strana – ® i ™ – vlasništvo su njihovih vlasnika. © 2000-2024 Beo-lab laboratorije. Sva prava zadržana